二氧化锰,自然界以软锰矿形式存在。
物理性状:黑色无定形粉末,或黑色斜方晶体。
溶解性:难溶于水、弱酸、弱碱、硝酸、冷硫酸,加热情况下溶于浓盐酸而产生氯气。
化学性质
酸碱性:二氧化锰是两性氧化物,它是一种常温下非常稳定的黑色粉末状固体,可作为干电池的去极化剂。
在实验室常利用它的氧化性,和浓HCl作用以制取氯气:二氧化锰在酸性介质中是一种强氧化剂。
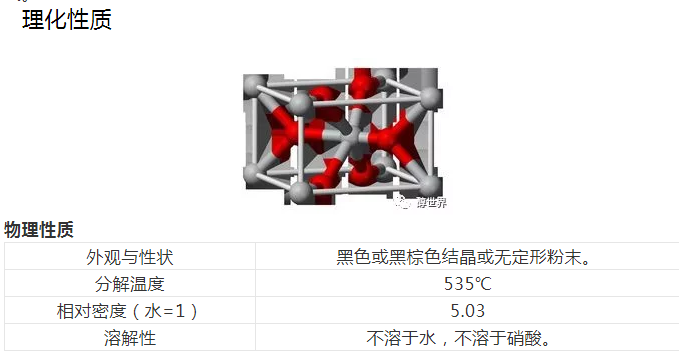
二氧化锰是[MnO?]八面体,氧原子在八面体角顶上,锰原子在八面体中, [MnO?]八面体共棱连接形成单链或双链,这些链和其它链共顶,形成空隙的隧道结构,八面体或成六方密堆积,或成立方密堆积。
二氧化锰是一种两性氧化物,存在对应的BaMnO3或者SrMnO3这样的钙钛矿结构的形式上的盐(通过熔碱体系中的化合反应得到) [2] ,也存在四氯化锰。
遇还原剂时,表现为氧化性。如将二氧化锰放到氢气流中加热至1400K得到氧化锰;将二氧化锰放在氨气流中加热,得到棕黑色的三氧化二锰;将二氧化锰跟浓盐酸反应,则得到l氯化锰、氯气和水。
遇强氧化剂时,还表现为还原性。如将二氧化锰,碳酸钾和硝酸钾或氯酸钾混合熔融,可得到暗绿色熔体,将熔体溶于水冷却可得六价锰的化合物锰酸钾。在酸件介质中是一种强氧化剂。
强氧化剂,自身不燃烧,但助燃,不要和易燃物放置一起。
在氯酸钾[KClO3]分解、双氧水(过氧化氢,H2O2)分解的反应中作催化剂:
英文别名
BLACK MANGANESE OXIDE;
MANGANESE(+4)OXIDE;
MANGANESE BIOXIDE;
MANGANESE DIOXIDE;
MANGANESE DIOXIDE, ACTIVATED;
MANGANESE (IV) DIOXIDE;
MANGANESE(IV) OXIDE ACTIVATED;
MANGANESE(IV) OXIDE ON CARRIER;
MANGANESE OXIDE;
C.I. 77728
EINECS215-202-6
分子量:86.94
制备方法
主要取自天然矿物软锰矿。普遍采用高温硫酸锰溶液电解法制取,碳酸锰矿和软锰矿均可作为原料。硫酸锰溶液的制备包括浸取、除铁、中和、除重金属、过滤、静置除钙镁等工序,经高温电解后制得粗产品,再经处理包括剥离、粉碎、洗涤、中和与干燥等过程制得合格晶。当采用氯化锰溶液电解可制得纤维状二氧化锰。还有碳酸锰、硝酸锰热解法,由低价氧化锰与氧化剂如氯酸钠、氯气、氧气等分别组合反应直接氧化制得。
硫酸锰
将菱锰矿粉与硫酸按质量比值1 : 1.8~1 : 2.0混合进行反应,生成硫酸锰,正常情况下使用电解槽的循环酸,并补充部分硫酸,待pH=4时,加入少量二氧化锰粉,将溶液中Fe2+氧化成Fe3+,再加石灰乳中和至pH近中性,加人硫化钡饱和溶液,使重金属离子生成硫化物沉淀,经过滤配制成电解液组成:MnSO4=120±20 g/L、H2SO4=30±10 g/L,在温度93±5℃,槽电压2~3 V下,通常经20~30天电解,在阳极上沉积生成块状粗品,粗品经剥离、粉碎、用水多次漂洗,并加入碳酸氢钠中和至pH=5~7,再经过滤、干燥、粉碎,制得电解二氧化锰产品。
化学方程式为:
MnCO3+H2SO4=MnSO4+H2O+CO2↑
2FeSO4+MnO2+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Fe2(SO4)3+6H2O=3H2SO4+2Fe(OH)3↓
MnSO4+2H2O=电解=MnO2↓+H2SO4+H2↑
氯化锰法将菱锰矿与过量盐酸进行反应,生成氯化锰溶液,待反应完成后,加入石灰进行中和,控制Ph=4左右,加入氧化剂过氧化氢使Fe2+氧化生成氢氧化铁沉淀而除去,净化的氯化锰溶液加入硝酸锰配成电解液,使氯化锰浓度0.5~2.0 mol/L,HCl的浓度0.01~1.0 mol/L。电解液中可加入含量10%~15%的硝酸锰,在温度85~95℃下电解,这样可解决电解过程中微量氯放出反应所造成的空气污染及腐蚀问题。电解得到纤维状二氧化锰,再经粗品剥离、粉碎、中和漂洗、过滤、干燥、粉碎,制得电解二氧化锰产品。
化学方程式为:
MnCO3+2HCl=MnCl2+H2O+CO2↑
MnCl2+2H2O=电解=MnO2↓+2HCl+H2↑
多为地下开采,一般工艺流程同“磷块岩”。常用的选矿方法有手选、磁选、浮选、重选等,此外化学选矿和细菌浸取法用于锰矿石有大量试验。
锰矿选矿工艺流程如下:
硝酸锰法将软锰矿与煤粉混合,经还原焙烧使高价锰还原成一氧化锰,用硝酸及硫酸浸取,经过滤、净化,得硝酸锰溶液,再经浓缩、热分解得二氧化锰,最后经稀硝酸精制、硫酸活化处理、水洗、干燥,制得化学二氧化锰产品。
化学方程式为:
MnO2+C=MnO+CO↑
MnO2+CO=MnO+CO2↑
MnO+2HNO3=Mn(NO3)2+H2O
Mn(NO3)2=MnO2+2NO2↑
碳酸锰法软锰矿细粉碎与煤粉混合,进行还原焙烧生成氧化锰,用硫酸浸取,所得硫酸锰溶液中和到Ph4~6,沉淀杂质过滤除渣,滤液加硫化钠净化,经压滤,加入碳酸氢铵及晶种生成碳酸锰沉淀,在空气中通水蒸气于大约450℃下焙烧热分解,生成二氧化锰,剩余的碳酸锰及低价氧化锰,经硫酸溶出,氯酸钠重质化,再经洗涤,烘干得化学二氧化锰。
化学方程式为:
2MnO2+C=2MnO+CO2↑ MnO+H2SO4=MnSO4+H2O MnSO4+2NH4HCO3=MnCO3+CO2+H2O+(NH4)2SO4 MnCO3+0.5O2=MnO2+CO2↑ MnCO3+H2SO4=MnSO4+H2O+CO2↑ 5MnSO4+2NaClO3+4H2O=5MnO2+Na2SO4+4H2SO4+Cl2↑ [5]
天然锰矿活化法
将高质量的软锰矿在空气中加热到600~800℃,或在还原剂(如煤粉、天然气)存在下,加热到300℃进行还原焙烧,使二氧化锰还原生成三氧化二锰,还原产物再经热硫酸处理,歧化三氧化二锰得到高活性.γ-MnO2和硫酸锰,酸浸后浆液经过滤、洗涤、干燥、制得活性二氧化锰。
化学方程式为:
2MnO2+C=Mn2O3+CO↑
Mn2O3+H2SO4=MnSO4+MnO2+H2O
晶粒型活性二氧化锰
高活性( 放电性能优异) 天然二氧化锰( NMD) 直接用作电池的正极材料。随着时间的推移,其资源已日趋枯竭。研究使用低活性高品位天然二氧化锰,一直是锰工业和电池工业科技工作者所关助与 研究热点。大量试验基础上有人曾提出以 “电解二氧化锰( EMD) 电解液为酸性介质的歧化活 化,添加少量 NaClO3 和含铝聚氯化物”的活化体 系,对研制活性二氧化锰的焙烧、歧化活化及活化体 系的最佳优化组合进行了深入研究。
以前研究工作基础上,借鉴化学二氧 化锰工艺技术,以“微粒电解二氧化锰( CEMD) 电解液为酸性介质的歧化活化,NaClO3 为氧化剂的 氧化重质化,含铝聚氯化物浸渍”的新型活化体系, 活化 了 低 活 性 高 品 位 天 然 二 氧 化 锰 的 焙 烧 粉 ( Mn2O3 ) 而制成晶粒型高活性二氧化锰电池正极材 料。该产品具有丰富的吸液能力和较大的比表面 积,以及优异的放电性能,尤其是 2 Ω 重负荷连放 和3. 9 Ω 轻负荷间放。由于研制样品各项物理化学 性能和电化学性能接近或趋于接近 EMD。在电池 生产中,可以部分或全部替代价格昂贵的电解二氧 化锰,潜在经济效益显现,开发应用前景广阔。
三氧化二锰( Mn2O3 ) 粉体的制备
取一定量的天然二氧化锰矿,烘干,粉磨至全部 通过 100 目筛,在 700℃的转炉中热分解焙烧1. 5 h, 使天然二氧化锰矿粉中 MnO2 转化为 Mn2O3,取出 粉体冷却到常温,充分研碎即得 Mn2O3 粉体。
活性二氧化锰的制备
取一定量 Mn2O3 粉体置于“微粒电解二氧化锰 ( CEMD) 电解液 + NaClO3 氧化剂 + 含铝聚氯化 物”为介质的新型活化体系中,控制活化温度 80℃ 左右,歧 化 活 化 时 间 2 h。活 化 结 束 后,用 10% NaOH 溶液中和洗涤,调整 pH 值为 6 左右,经搅拌、 过滤、烘干即得晶粒型活性二氧化锰。
关于新型活化体系活化机理:在酸性介质中,Mn2O3 粉体歧化活化成活性二 氧化锰,其主反应式为:
Mn2O3 + 2H + →MnO2 + Mn2 + + H2O
从化学反应式看,以硫酸( H2 SO4 ) 为酸性介质 活化时,Mn2O3 粉体自身发生氧化还原反应,也就是 歧化反应,生成的固体物质为活性二氧化锰,溶液物 质为硫酸锰。一些文献提出将硫酸锰溶液净化后制 备成固体硫酸锰。大量试验发现,以 H2 SO4 为酸性 介质活化 Mn2O3 粉体过程中所产生的 MnSO4 并不 多,而以 H2 SO4 为酸性介质的活化体系又成为可 能。因此,在大量试验基础上,借鉴化学二氧化 锰工艺技术,提出以“CEMD 电解液为酸性介质的歧 化活化,NaClO3 为氧化剂的氧化重质化,含铝聚氯 化物为浸渍”的新型活化体系。
Mn2O3 + H2 SO4 = MnO2↓ + MnSO4 + H2O ( 1)
MnSO4 +2NaClO3 =MnO2↓+Na2SO4 +Cl2↑+2O2↑ ( 2)
5MnSO4 + 2NaClO3 + 4H2O = 5MnO2↓ + Na2 SO4+ 4H2 SO4 + Cl2↑ ( 3)
4MnSO4 + 4MnO -4 + 2H2O = 8MnO2↓ + 4HSO -4+ O2↑ ( 4)
2MnSO4 + O2 + 2H2O = 2MnO2↓ + 2H2 SO4 ( 5)
Fe2O3 + 3H2 SO4 = Fe2 ( SO4 ) 3 + 3H2O ( 6)
Fe2 ( SO4 ) 3 + 6H2O = 2Fe( OH) 3↓ + 3H2 SO4 ( 7)
MeO + H2 SO4→MeSO4 + H2O( Me 为金属元素) ( 8)
关于 CEMD 电解液的选择
研究 EMD 电解液作为活化体系时发现, EMD 电解液中 H2 SO4 浓度( 约 0. 5 mol /L) 太低,影响 Mn2O3 粉体歧化活化,在活化过程中需要补充比 较多 的 浓 H2 SO4,而 CEMD 电 解 液 含 有 2. 5 ~ 3. 2 mol /L H2 SO4 浓度正好满足歧化活化 Mn2O3 粉 体需要的酸性介质。有学者研究成果介 绍说,当介质 H2 SO4 浓度超过 3 mol /L 时,随着 H2SO4 浓度的升高,Mn3 + 在 H2 SO4 介质中的稳定性 增强,Mn2O3 粉体歧化活化生成 MnO2 速度缓慢,产品结晶度增加,致使活性二氧化锰产品制成实体电池时电容量容易下降。因 此,CEMD 电解液含有2.5 ~ 3.2 mol /L H2 SO4 浓度是刚好是理想活化体系浓度,在活化过程中,不再用补充新的浓 H2 SO4。
关于 NaClO3 氧化剂的添加
添加 NaClO3 氧化 剂,主 要 是 氧 化 活 化 歧 化 Mn2O3 粉体过程中产生微量 MnSO4 和 CEMD 电解 液中固有富量 MnSO4,空气中的氧也与 MnSO4 发生 微弱的氧化反应,电解液中存在的微量 MnO4 - 离子 也与 MnSO4 发生化学反应。这些化学反应的生成 物就是晶粒型化学二氧化锰,粒度一般在 5 μm 左 右,这些晶粒部分填充在活性二氧化锰微孔中,部分 吸附在活性二氧化锰微粒表面,其余均匀有序排列 于活性二氧化锰微粒之间。晶粒型的化学二氧化锰 与活化型二氧化锰互相渗透、吸附、黏结、排序,使 “活化物”在化学性能、物理性能及电化学性能上相 互“扬长避短与互为补充”。因此,研制的“活化物” 简称为“晶粒型活性二氧化锰”。
最终结论
1) 以“微粒电解二氧化锰( CEMD) 电解液为酸 性介质的歧化活化,NaClO3 为氧化剂的氧化重质 化,含铝聚集氯化物为浸渍”的新型活化体系,活化 NMD 焙烧粉( Mn2O3 粉) 而制成晶粒型高活性二氧 化锰的方法是可行的。
2) 新型活化体系中发生歧化、吸附、填充、重 排、质化、浸渍等系列“动作”,使“活化样”在化学性 能、物理性能及电化学性能上相互得到“扬长避短 和互为补充”,从根本上改善了“活化样”的物理性 能、化学性能及电化学性能。
3) 新型活化体系研制的样品,具有丰富的吸液 能力( 0. 249 cm3 /g) 和较大的比表面积( 58. 93 cm2 /g) , 以及优异的放电性能。
4) 新型活化体系活化研制的样品,各项物理化 学性能和电化学性能接近或趋于接近电解二氧化 锰。在电池生产过程中,活化样品可以部份或全部 替代价格昂贵的电解二氧化锰,潜在经济效益明显, 开发应用价值前景广阔。
应用领域:用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。用于制造金属锰、特种合金、锰铁铸件、防毒面具和电子材料铁氧体 等。另外,还可用于橡胶工业以增加橡胶的粘性。还可在化学实验中用做催化剂。
有机合成用途:二氧化锰在有机化学之中十分有用。被用于氧化物的二氧化锰的形态不一,因为二氧化锰有多个结晶形态,化学式可以写成MnO?-x(H?O)n,其中x介乎0至0.5之间,而n可以大于0。二氧化锰可在不同pH下的高锰酸钾(KMnO?)和硫酸锰(MnSO?)的反应之中产生。啡色的二氧化锰沉淀物很干和很活跃。最有效的有机溶包括芳香性物质、四氯化碳、醚、四氢呋喃和酯类等。
其中一个二氧化锰专用的化学反应是将醇类转化为醛类。即使该醇类中有双键,也不会被二氧化锰所氧化:cis-RCH=CHCH2OH + MnO2 → cis-RCH=CHCHO + H2O + MnO
当中的产物即使有多活跃也不会再被氧化。二醇类可被二氧化锰氧化为二醛。其他二氧化锰的反应极之多,可用在氧化出胺、芳香物和三醇等。 [7]
实验室用途:用做过氧化氢(双氧水)分解制氧气时的催化剂。
用做加热氯酸钾分解制氧气时的催化剂。
与单质铝粉发生铝热反应,制得锰。
用作颜料、黄色玻璃等。
与热的浓盐酸反应制取氯气。
与熔融苛性钾(氢氧化钾)在空气中反应制取锰酸钾。
高锰酸钾分解反应中,二氧化锰作为高锰酸钾的自催化剂。
质量指标:指标名称 一等品 合格品
二氧化锰的质量分数/%≥ 90 88
总锰(Mn)质量分数/%≥ 59 58
铁(Fe)/%≤ 0.35
水分/%≤ 3.0
酸不溶物/%≤ 0.3 0.4
碱和碱土金属/%≤ 2.0
pH值 5~7
健康危害:过量的锰进入机体可引起中毒。主要损害中枢神经系统,尤其是锥体外系统工业生产中急性中毒少见,若短时间吸入大量该品烟尘,可发生“金属烟热”,病人出现头痛、恶心、寒战、高热、大汗。慢性中毒表现有神经衰弱综合征,植物神经功能紊乱,兴奋和抑制平衡失调的精神症状,重者出现中毒性精神病;锥体外系受损表现有肌张力增高、震颤、言语障碍、步态异常等。
燃爆危险:该品不燃,具刺激性。
急救措施
皮肤接触:脱去污染的衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入:饮足量温水,催吐。就医。
消防措施
危险特性:未有特殊的燃烧爆炸特性。受高热分解放出有毒的气体。
有害燃烧产物:自然分解产物未知。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。灭火时尽可能将容器从火场移至空旷处。
泄漏应急处理
应急处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。 [1]
操作处置储存
操作注意事项:密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。远离易燃、可燃物。避免产生粉尘。避免与还原剂、酸类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。应与易(可)燃物、还原剂、酸类分开存放,切忌混储。储区应备有合适的材料收容泄漏物。